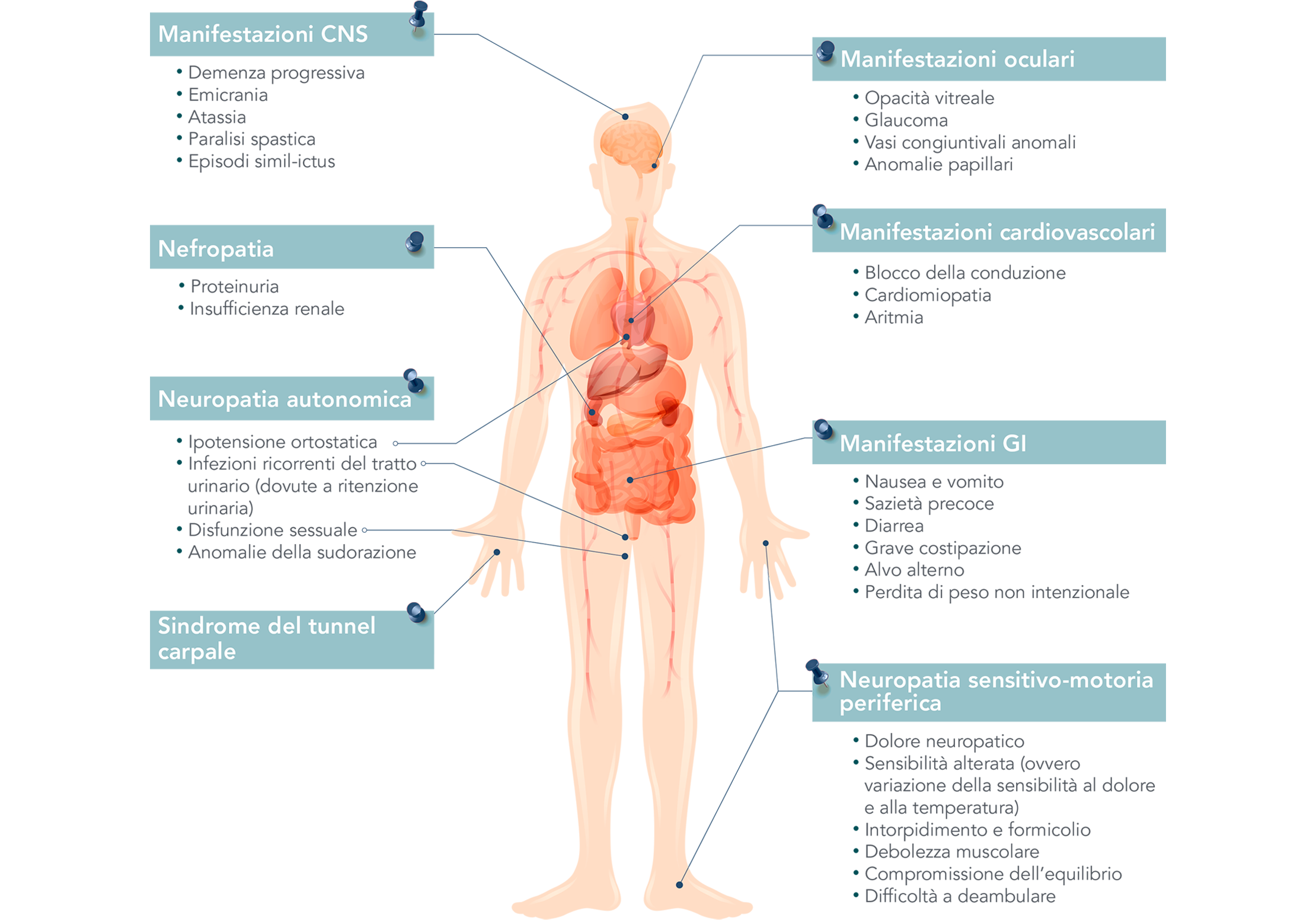
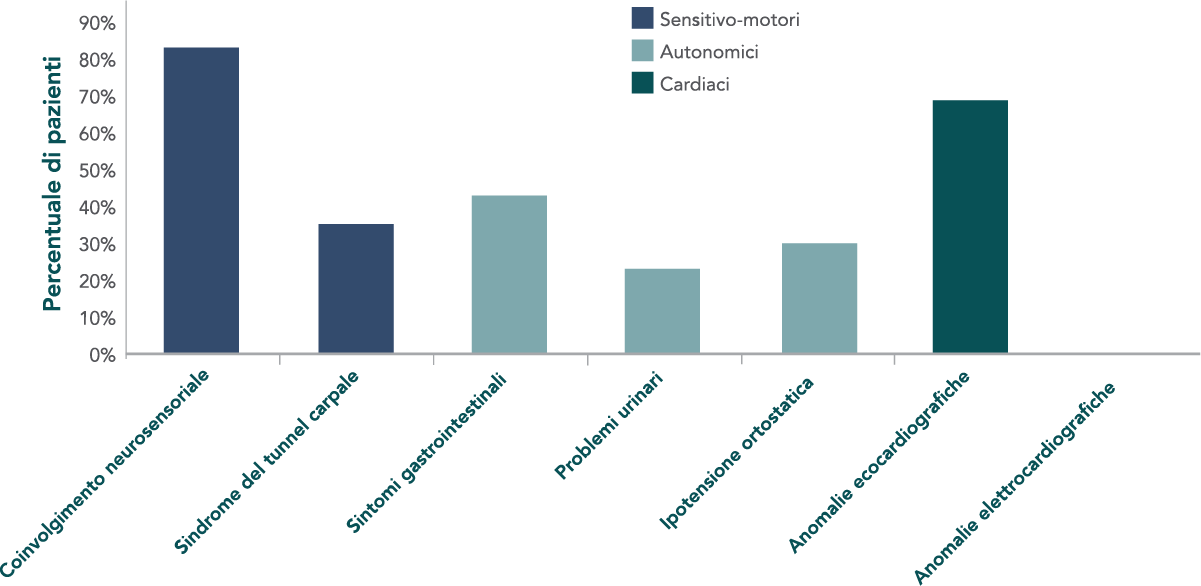
Stai per lasciare il sito web hattramyloidosis.it
La invitiamo a leggere e valutare i termini di utilizzo, privacy, sicurezza e altre politiche simili del sito di destinazione in quanto potrebbero differire dagli standard del sito che sta per lasciare.
Siti di terze parti
Alnylam non si assume alcuna responsabilità né controlla, approva o garantisce alcun aspetto dell’utilizzo da parte sua di siti di terze parti. Inoltre, la presenza di questo link non implica l'approvazione del sito da parte di terzi.
Grazie per aver visitato il nostro sito.